近日,2025年诺贝尔生理学或医学奖被三位免疫学家收入囊中[1],他们的核心发现——调节性T细胞(简称Treg),为全球数亿自身免疫性疾病患者带来了新希望。这个藏在免疫系统里的神秘角色,究竟有着怎样的本领,能成为对抗疾病的关键?

▲图片来源:诺贝尔奖委员会官网▲
01
Treg:免疫系统的“刹车安全员”
我们的免疫系统就像一支时刻待命的 “防御部队”,细菌、病毒等外来“敌人”入侵时,它会立刻出动反击。可这支战斗力强劲的部队,也需要“指挥和约束”—— 要是没了管控,就会像失控的战车,不分敌我地攻击自身健康细胞和正常组织,这就是自身免疫性疾病的根源。而Treg,正是免疫系统里的“刹车安全员”。
正常情况下,当免疫细胞完成防御任务,Treg就会及时“踩下刹车”:它会抑制过度活跃的免疫细胞,让免疫反应平稳下来,避免健康组织被误伤。可一旦Treg出了问题,例如数量不足或功能失效,“刹车系统”就会失灵,免疫系统随即陷入混乱,开始疯狂攻击关节、皮肤、肾脏等自身器官,自身免疫性疾病也就随之而来。

02
自身免疫疾病:“刹车失灵”引发的“内乱”
像我们常听说的类风湿关节炎、系统性红斑狼疮、银屑病等,本质上都是“刹车失灵”引发的免疫系统紊乱。患者可能常年被关节肿痛折磨,或被皮肤症状影响生活,严重时甚至会损伤内脏,大大降低生活质量。过去,这类疾病的治疗多是“治标”,很难从根源上修复免疫系统的“刹车”,直到Treg的发现带来了转机。
03
从基础研究到临床希望:孟颂东团队新突破
三位诺奖科学家的研究,率先揭开了Treg的神秘面纱,为人类研究免疫系统“刹车机制”奠定了关键基础。在这一重要突破的指引下,国内外科研团队也持续深耕这一领域,中国科学院微生物研究所孟颂东教授团队便是其中一员。他们经过多年探索发现,高浓度、高剂量的gp96通过TLRs(主要是TLR1/2)可以激活NF-κB通路,上调FoxP3的表达,从而增加Treg的数量并增强其抑制功能,使过强的免疫系统重新恢复稳态,从而起预防和治疗系统性红斑狼疮等自身免疫性疾病作用。
2021年12月,孟颂东教授团队在iScience期刊上发表研究[2],阐明了gp96介导的Treg激活的机制,在系统性红斑狼疮和自身免疫性脑脊髓炎的小鼠模型中验证了活化的Treg可有效抑制自身抗体和Th细胞诱导的自身免疫性疾病,为研发通过激活Treg治疗自身免疫性疾病的药物提供了依据。
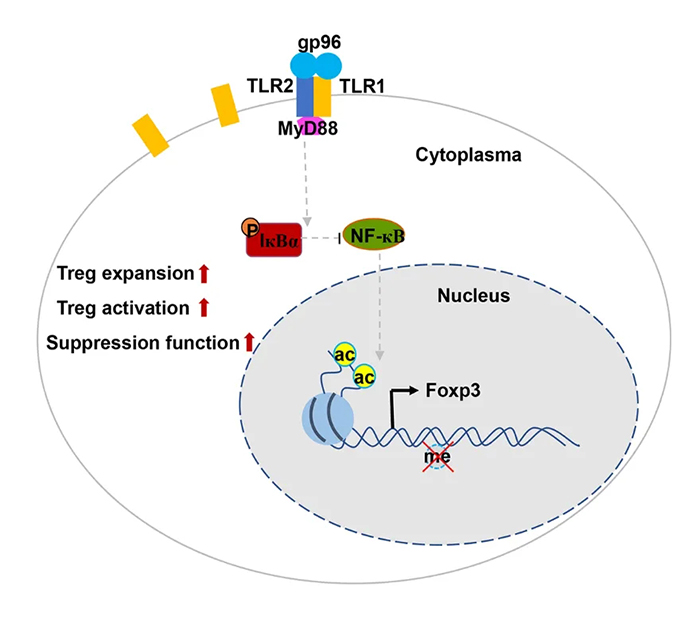
▲热休克蛋白gp96活化Treg的机制▲
随着热休生物的不断深耕,以热休克蛋白gp96为基础的自身免疫性疾病新药研发终于从动物模型走向临床研究。2025年9月,由热休生物主导开展的“高剂量gp96治疗ALS(渐冻症)首个人体临床试验”成果,正式发表于《The Innovation Medicine》期刊[3]。该研究作为gp96治疗渐冻症的首个临床研究,证实了其安全性良好的同时,具有强大的免疫调节功能与疗效,深度分析发现gp96治疗的持续时间、Treg的活化与疗效呈正相关,为后续开发提供了有力支撑。
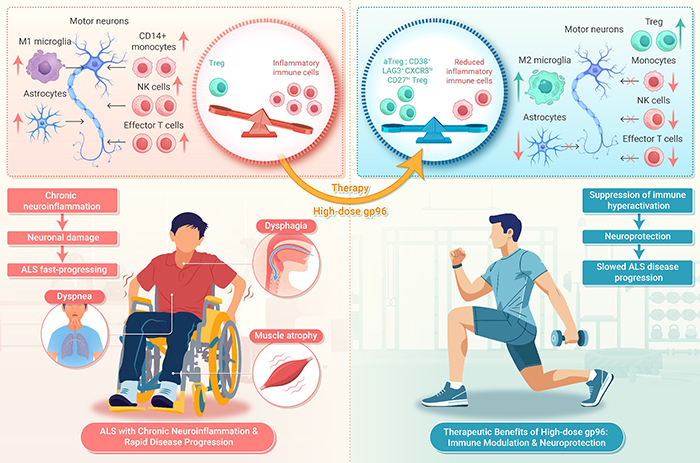
▲热休克蛋白gp96治疗渐冻症的机制▲
未来,随着对Treg调控机制的深入探索,或许我们真能彻底修复免疫系统的“刹车”,让数亿患者摆脱病痛困扰。
参考资料:
[1]https://www.nobelprize.org/prizes/medicine/2025/press-release/
[2]https://www.sciencedirect.com/science/article/pii/S2589004221014164
[3]https://www.the-innovation.org/article/doi/10.59717/j.xinn-med.2025.100157