结直肠癌
gp96激活患者免疫系统在结直肠癌自身肝转移患者的肿瘤中提取的HSPPC-gp96(Oncophage)疫苗接种于手术治疗后的患者,诱导肿瘤特异性T细胞应答。在29例患者中,手术2年后患者总生存率和无病生存率分别为79%和32% (图1)。有15例(52%)观察到先前存在的I类HLA限制性T细胞介导的抗结肠癌反应发生了显著的增加且未观察到相关毒性。与无应答的受试者相比,有免疫应答的患者2年总生存和无病生存期显著改善,独立于其他临床预后因素,具有统计学上显著的临床优势(2年总生存为100%vs50%,P=0.001,图2A;无病生存期为51%vs8%,P=0.0001,图2B)。疫苗能显著促进CD8+ T细胞对结肠癌的应答,使患者可以更好的无瘤生存[1]。
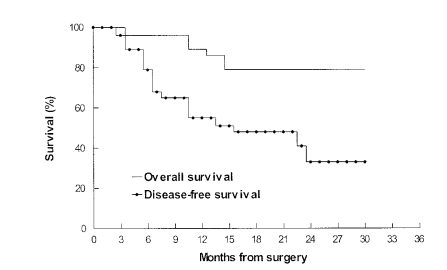
图1 29例肝转移的直肠癌患者术后接受gp96自体免疫治疗的生存率。总生存率和无病生存率分别为79%和32%。中位随访为24个月。
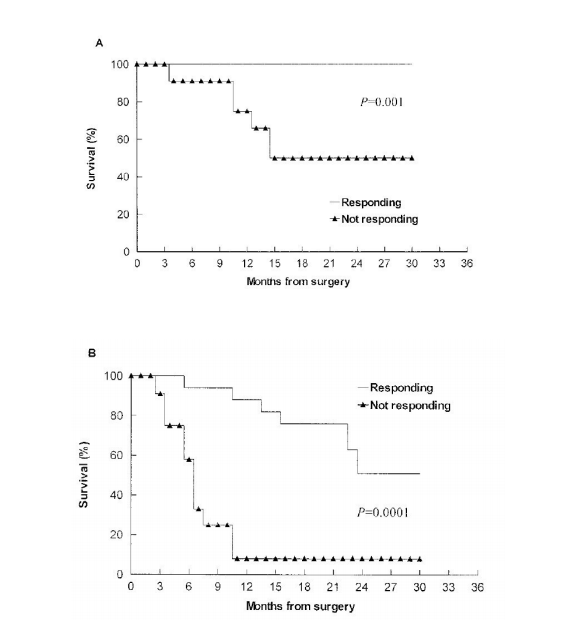
图2 肝转移的直肠癌患者术后接受gp96自体免疫治疗后有免疫反应和无免疫反应的不同临床结果。
还有研究发现,使用从黑色素瘤和结直肠癌患者的自体肿瘤组织中纯化的热休克蛋白gp96进行疫苗接种,大约50%接种疫苗的患者可以产生或增强黑色素瘤特异性T细胞应答,在经手术治愈的大肠癌肝转移患者中也得到了类似的结果,表明该疫苗诱导的T细胞免疫应答与黑色素瘤(肿瘤应答)和结直肠癌患者(无病和5年总生存期)的临床应答之间存在明确的关联[2]。

接种自体肿瘤HSPPC-96疫苗后患者体内抗肿瘤T细胞和NK细胞增加。
热休克蛋白除参与适应性免疫系统的激活外,对结直肠癌患者接种自体肿瘤提取的GP96,在NK敏感靶标存在的情况下,使自然杀伤细胞活性显著增强。此外,即使在没有单核细胞的情况下,CD56+淋巴细胞在体外接触GP96时也会发生功能和表型激活,这支持了GP96对这些细胞亚群的潜在直接活性[3]。
黑色素瘤
在入选的36例患者中,72%为IV期黑色素瘤,83%之前接受过全身治疗。自体肿瘤来源的热休克蛋白肽复合物96 (HSPPC-96)以三种剂量水平之一制备(2.5、25或100 μg/剂量),全部36例患者均接受了治疗,没有发现严重的毒性反应。11名IV期⿊⾊素瘤的患者的⽆进展⽣存率和总⽣存率分别为45%和82%,中位随访时间为10年。自体肿瘤源性HSPPC-96在所有试验剂量下都是可行和安全的,观察到的免疫效果和抗肿瘤活性适中,排除了生物活性剂量的选择[4]。
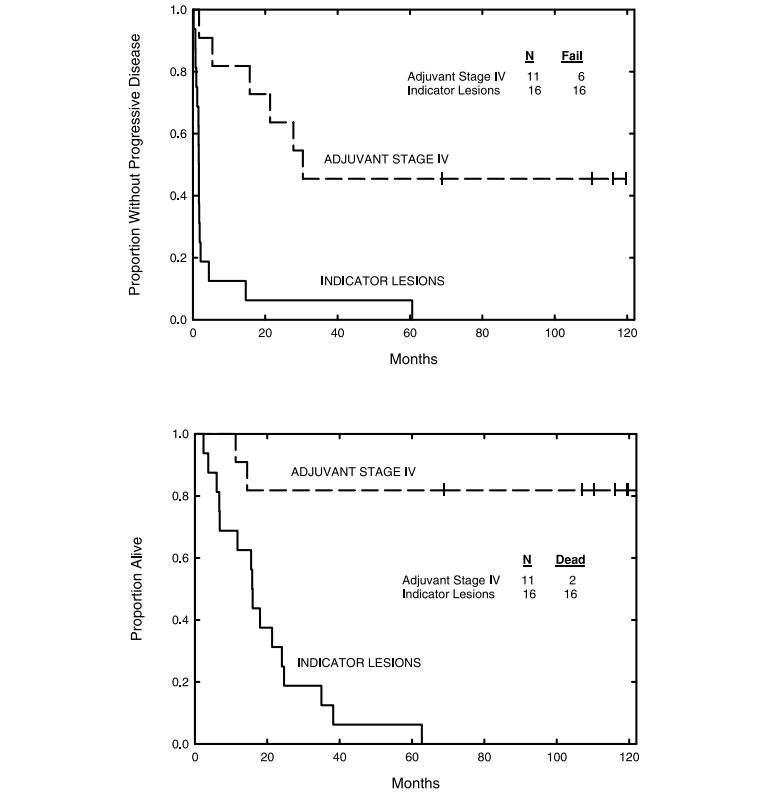
11名IV期⿊⾊素瘤的患者的⽆进展⽣存率和总⽣存率分别为45%和82%,中位随访时间为10年。
第二项研究也确认了自体的、肿瘤来源的热休克蛋白gp96肽复合物的抗肿瘤活性。患者(N=322)被随机分配为2:1,接受含有达卡巴嗪、替莫唑胺、白细胞介素-2或gp96肽复合物治疗。这项开放标签试验在全球71个中心进行,对患者的安全性和总生存率进行监测。结果表明gp96肽复合物对患者无明显毒性。结果显示,两组的总生存率在统计学上无显著差异,接受gp96肽复合物免疫的M1a和M1b亚期患者比接受较少此类治疗的患者存活时间更长,但在M1c分期患者中未检测到这种差异[5]。
胰腺癌
一项I期临床试验,确定从完全切除的胰腺肿瘤中纯化自体疫苗HSPPC-96 (gp96, Oncophage)的可行性,并探讨治疗患者的免疫反应和临床结果。受试者每周接种4次5μg自体HSPPC96疫苗,除此之外,受试者既未接受辅助化疗,也未接受放疗。10名患者接受了完整疗程的疫苗接种后,未遇到剂量限制毒性且中位总生存期为2.2年(标准治疗药物吉西他滨单药治疗的中位生存期是6个月,显著延长4倍)。10名接受治疗的患者中有3人在2.6年、2.7年和5.0年随访时无病生存[6]。
惰性非霍奇金淋巴瘤
这项研究仍在进行中,迄今已有20名患者参加了这项Ⅱ期临床试验,这些患者的中位年龄为58岁(范围45-83岁),成功制备了17例不同惰性组织(滤泡型,n = 9;小淋巴细胞,n = 6;边缘区,n = 2),提示可从大多数惰性淋巴瘤患者中制备HSPPC-96,而不考虑其组织学亚型。患者接受了中位数4次疫苗接种(范围1-14剂)。患者接受了中位数4次疫苗接种(范围1-14剂),耐受性非常好,几乎没有观察到不良影响。在可评估的患者中,滤泡性淋巴瘤、小淋巴细胞性淋巴瘤和边缘区淋巴瘤的疗效持续时间分别为8、12和13个月。数据初步表明,这种新型疫苗制剂在惰性淋巴瘤患者中的临床治疗是有效的[7]。
胶质母细胞瘤
复发性多形性胶质母细胞瘤(GBM)患者预后较差,可通过免疫治疗改善。在一项开放标签、单臂、Ⅱ期研究中,可手术切除的复发性GBM成人患者在全切除后接种自体热休克蛋白肽复合物-96 (HSPPC-96)疫苗,主要终点是6个月的总生存期;次要终点包括总生存期、无进展生存期、安全性和免疫分析。在意向治疗人群和疗效人群中进行结果分析发现,在2007年10月3日至2011年10月24日期间,41例患者接受了复发性GBM的全切除,并接受了中位数的6剂HSPPC-96疫苗。治疗后,90.2%的患者6个月存活(95%置信区间[CI]: 75.9-96.8), 29.3%的患者12个月存活(95% Cl: 16.6-45.7),中位总生存期为42.6周(95% Cl: 34.7-50.5)。27例(66%)患者在治疗前淋巴细胞减少,淋巴细胞计数低于队列中位数的患者显示总生存期降低(风险比:4.0;95% Cl: 1.4-11.8;P=0.012),无治疗相关死亡病例。报告了37例严重(3-5级)不良事件,其中只有1例与疫苗相关的3级机体不良事件。结论:HSPPC-96疫苗治疗复发性GBM是安全的,值得进一步研究[8]。
另一项研究表明,多形性胶质母细胞瘤(GBM)脑组织中与gp96结合的多肽可用于复发性GBM患者的安全免疫。对12例复发性GBM患者在接受手术切除肿瘤提取的自体HSPPC96疫苗免疫前和免疫后进行多模式免疫监测。临床终点包括安全性评估和总生存率。结果显示:未发现与疫苗相关的不良事件。对接种疫苗前后外周血白细胞的检测显示,在12名接受治疗的患者中,有11人出现了针对与gp96结合的多肽的显著外周免疫反应。接种疫苗后免疫应答者的脑组织活检显示局灶性CD4+、CD8+、CD56+和IFNγ+细胞浸润,与肿瘤部位特异性免疫应答一致。免疫应答者在手术和接种疫苗后的中位生存期为47周,而单个无应答者的中位生存期为16周。结论:这些数据表明个体患者对自体肿瘤源性多肽结合gp96产生特异性免疫反应[9]。
在一项开放标签、单臂、I期研究中,成人患者在手术切除后新诊断的GBM患者联合使用标准治疗方法接种HSPPC-96疫苗。主要终点为不良事件发生频率和6个月无进展生存期(PFS)。次要终点包括总生存率(OS)、PFS和肿瘤特异性免疫反应(TSIR)。2013年9月至2015年2月共入组20例新诊断的GBM患者。未发现3级或4级疫苗相关不良事件。中位随访时间为42.3个月,6个月时PFS为89.5% (95% CI, 66.9%-98.7%),中位PFS为11.0个月(95% CI, 8.2-13.8),中位OS为31.4个月(95% CI, 14.9-47.9)。接种疫苗后TSIR显著增加2.3倍(95% CI, 1.7-3.2)。接种后TSIR高的患者的中位OS为>40.5个月(95% Cl,不可计算),而接种后TSIR低的患者的中位OS为14.6个月(95% CI, 7.0-22.2)(危险比,0.25;95%置信区间,0.071-0.90;P = 0.034)。多变量Cox回归模型显示疫苗接种后TSIR是生存的主要独立凹陷预测因子。结论:HSPPC-96疫苗与标准疗法相结合,是治疗新诊断的GBM患者的一种安全有效的策略。疫苗接种后TSIR是预测疫苗疗效的良好指标[10]。
肾癌
局限性肾细胞癌的治疗包括部分切除或根治性切除,有研究前瞻性地检查了肾切除术后接受热休克蛋白肽复合物96 (HSPPC-96)疫苗治疗的转移性肾细胞癌患者的生活质量(QOL),对36例初诊期肾细胞癌患者、治疗3周后治疗结束日及随访1个月时的生活质量和侵入思想进行测定。在每次评估中,患者完成RAND 36项健康调查和事件影响量表(IES)。混合模型分析显示,随着时间的推移,物理成分总结分数有显著提高(p<0.0001)。结论:HSPPC-96疫苗治疗期间,患者生活质量保持稳定或改善[11]。
另一项研究评估了在接受肾切除术的IV期转移性肾细胞癌(RCC)患者中,通过使用与不使用白细胞介素-2 (IL-2,Chiron, Emoryville, CA, USA)的自体HSPPC-96(Oncophage, Antigenics Inc, New York NY, USA)的时间进展和应答率(RR)来确定临床疗效。84例患者被纳入研究,然后接受了肾切除术和肿瘤组织的收集,用于自体疫苗生产。最初的治疗计划大约在术后4周开始,包括6次注射(疫苗在第1、2、3、4、6、8周注射)。然后在第10周或前后重新调整,病情稳定或反应性疾病的患者继续接种疫苗,每两周再接种四次疫苗(在第10、12、14、16周)。在第10周评估时病情进展的患者接受了连续4个每周5天的11 x 10U IL-2皮下注射疗程(第10、11、12、13周)。每隔2周(第10、12、14、16周)使用4剂HSPPC-96。在下一次评估中,完全应答的患者再接受两个周期的HSPPC-96疫苗,或直到疫苗供应耗尽。病情稳定或部分缓解的患者重复先前的治疗周期。尚未接受IL-2治疗的疾病进展者开始接受IL-2治疗,而已经接受IL-2治疗的疾病进展者退出研究。60例可评估患者中,2例完全缓解(CR),2例部分缓解(PR)。7例病情稳定,33例病情进展。16例患者未证实病情稳定,2例仅接种疫苗进展的患者在加入IL-2后病情稳定。这项研究发现HSPPC-96疫苗与免疫调节剂联合使用可提高疗效[12]。
参考文献:
[1]Mazzaferro V, Coppa J, Carrabba MG, Rivoltini L, Schiavo M, Regalia E, Mariani L, Camerini T, Marchianò A, Andreola S, Camerini R, Corsi M, Lewis JJ, Srivastava PK, Parmiani G. Vaccination with autologous tumor-derived heat-shock protein gp96 after liver resection for metastatic colorectal cancer. Clin Cancer Res. 2003 Aug 15;9(9):3235-45. PMID: 12960108.
[2]Parmiani G, De Filippo A, Pilla L, Castelli C, Rivoltini L. Heat shock proteins gp96 as immunogens in cancer patients. Int J Hyperthermia. 2006 May;22(3):223-7. doi: 10.1080/02656730600647957. PMID: 16754342.
[3]Pilla L, Squarcina P, Coppa J, Mazzaferro V, Huber V, Pende D, Maccalli C, Sovena G, Mariani L, Castelli C, Parmiani G, Rivoltini L. Natural killer and NK-Like T-cell activation in colorectal carcinoma patients treated with autologous tumor-derived heat shock protein 96. Cancer Res. 2005 May 1;65(9):3942-9. doi: 10.1158/0008-5472.CAN-04-3493. PMID: 15867395.
[4]Eton O, Ross MI, East MJ, Mansfield PF, Papadopoulos N, Ellerhorst JA, Bedikian AY, Lee JE. Autologous tumor-derived heat-shock protein peptide complex-96 (HSPPC-96) in patients with metastatic melanoma. J Transl Med. 2010 Jan 29;8:9. doi: 10.1186/1479-5876-8-9. PMID: 20109236; PMCID: PMC2835652.
[5]Testori A, Richards J, Whitman E, Mann GB, Lutzky J, Camacho L, Parmiani G, Tosti G, Kirkwood JM, Hoos A, Yuh L, Gupta R, Srivastava PK; C-100-21 Study Group. Phase III comparison of vitespen, an autologous tumor-derived heat shock protein gp96 peptide complex vaccine, with physician's choice of treatment for stage IV melanoma: the C-100-21 Study Group. J Clin Oncol. 2008 Feb 20;26(6):955-62. doi: 10.1200/JCO.2007.11.9941. Erratum in: J Clin Oncol. 2008 Aug 1;26(22): 3819. PMID: 18281670.
[6]Maki RG, Livingston PO, Lewis JJ, Janetzki S, Klimstra D, Desantis D, Srivastava PK, Brennan MF. A phase I pilot study of autologous heat shock protein vaccine HSPPC-96 in patients with resected pancreatic adenocarcinoma. Dig Dis Sci. 2007 Aug;52(8):1964-72. doi: 10.1007/s10620-006-9205-2. Epub 2007 Apr 10. PMID: 17420942.
[7]Younes A. A phase II study of heat shock protein-peptide complex-96 vaccine therapy in patients with indolent non-Hodgkin's lymphoma. Clin Lymphoma. 2003 Dec;4(3):183-5. doi: 10.3816/clm.2003.n.029. PMID: 14715102.
[8]Bloch O, Crane CA, Fuks Y, Kaur R, Aghi MK, Berger MS, Butowski NA, Chang SM, Clarke JL, McDermott MW, Prados MD, Sloan AE, Bruce JN, Parsa AT. Heat-shock protein peptide complex-96 vaccination for recurrent glioblastoma: a phase II, single-arm trial. Neuro Oncol. 2014 Jan;16(2):274-9. doi: 10.1093/neuonc/not203. Epub 2013 Dec 12. PMID: 24335700; PMCID: PMC3895386.
[9]Crane CA, Han SJ, Ahn B, Oehlke J, Kivett V, Fedoroff A, Butowski N, Chang SM, Clarke J, Berger MS, McDermott MW, Prados MD, Parsa AT. Individual patient-specific immunity against high-grade glioma after vaccination with autologous tumor derived peptides bound to the 96 KD chaperone protein. Clin Cancer Res. 2013 Jan 1;19(1):205-14. doi: 10.1158/1078-0432.CCR-11-3358. Epub 2012 Aug 7. PMID: 22872572.
[10]Ji N, Zhang Y, Liu Y, Xie J, Wang Y, Hao S, Gao Z. Heat shock protein peptide complex-96 vaccination for newly diagnosed glioblastoma: a phase I, single-arm trial. JCI Insight. 2018 May 17;3(10):e99145. doi: 10.1172/jci.insight.99145. PMID: 29769450; PMCID: PMC6012501.
[11]Cohen L, de Moor C, Parker PA, Amato RJ. Quality of life in patients with metastatic renal cell carcinoma participating in a phase I trial of an autologous tumor-derived vaccine. Urol Oncol. 2002 May-Jun;7(3):119-24. doi: 10.1016/s1078-1439(01)00182-x. PMID: 12474545.
[12]Jonasch E, Wood C, Tamboli P, Pagliaro LC, Tu SM, Kim J, Srivastava P, Perez C, Isakov L, Tannir N. Vaccination of metastatic renal cell carcinoma patients with autologous tumour-derived vitespen vaccine: clinical findings. Br J Cancer. 2008 Apr 22;98(8):1336-41. doi: 10.1038/sj.bjc.6604266. Epub 2008 Mar 25. PMID: 18362942; PMCID: PMC2361701.